
약산
약산은 부분적으로 이온화한다.
기본 반응
HB (aq) + H2O ⇌ H3O+ (aq) + B- (aq)
약산으로 작용하는 두 가지 종류의 화학종
1. 이온화 될 수 있는 수소 원자를 가진 분자
HNO2 (aq) + H2O ⇌ H3O+ (aq) + NO2- (aq)
2. 양이온
NH4+ (aq) + H2O ⇌ H3O+ (aq) + NH3 (aq)
다음과 같이 많은 금속 양이온은 수용액에서 산으로 작용한다.
Zn(H2O)42+ (aq) + H2O ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq)
산소와 금속 양이온 간의 결합이 O-H 결합을 약화시킨다.
H+는 결합이 약해진 결과 쉽게 이온화된다.

약산의 평형상수
HB (aq) + H2O ⇌ H3O+ (aq) + B- (aq)
Ka 는 산의 평형 상수이다.
위의 식을 간단히 HB (aq) ⇌ H+ (aq) + B- (aq)라고 쓴다

Ka값은 약산의 세기와 관계가 있다.
Ka 값이 작을수록 산의 세기는 약하다.

pKa = -logKa
pKa값이 작으면 산의 세기는 크다.
pKa는 pH의 경향에 따른다.
이온화 백분율
약한 산의 백분율은 다음과 같이 정의된다.

백분율은 약산의 몰 농도에 의존함을 알 수 있다.

계산에 사용되는 근사법
Ka 의 값은 보통 ±5%의 오차를 갖는다.

평형 문제에서 사용되는 미지수를 풀 때, a가 약산의 초기 농도일 때, 분모에 있는 x 가 5% 이상의 오차는 넘지 않는다면 분모에 있는 x를 무시할 수 있다.

다음과 같은 경우,

100%를 곱하면 이온화 백분율이 된다
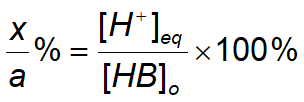
이온화 백분율이 5% 미만이면 근사법을 사용할 수 있다.
이온화 백분율이 5% 이상이면 이차 방정식의 근의 공식이나 연속적인 근사법을 사용하여야 한다.
예시문제


다양성자 약산
어떠너 약산은 다양성자산이다. 다양성자산은 하나 이상의 이온화될 수 있는 수소 이온을 가진다. 이러한 산은 각 단계별로 다른 평형 상수를가지고 있으며, 단계적으로 이온화된다. 대표적인 예로 인산은 삼양성자산이다.
H3PO4 (aq) ⇌ H+ (aq) + H2PO4- (aq) Ka1
H2PO4- (aq) ⇌ H+ (aq) + HPO4^2- (aq) Ka2
HPO42- (aq) ⇌ H+ (aq) + PO4^3- (aq) Ka3
산 평형 상수는 연속된 다음 단계로 갈수록 작아진다.
Ka1>Ka2>Ka3
연속된 단계에서 산이 점차적으로 약해지는 이유는 H3PO4와 같은 중성인 분자에서 보다 H2PO4-와 같이 음전하를 띠는 화학종에서 양으로 하전된 H+를 제거하는 것이 더 어렵기 때문이다.

*비금속 원자에 결합한 산소수가 증가할수록 O-H결합을 약화시켜 센산이 된다.*
출처 : 2016Cengage Learning
'과학 > 화학' 카테고리의 다른 글
| [산과 염기] 루이스(Lewis) 모형 (0) | 2021.05.31 |
|---|---|
| [산과 염기] 약염기, 약염기의 평형상수, Ka와 Kb의 관계 (0) | 2021.05.31 |
| [산과 염기] 브뢴스테드 로우리 산-염기, 물의 이온곱, pH (0) | 2021.05.26 |
| [산화-환원 반응] 산화수 규칙, 산화-환원반응 균형 맞추기 (0) | 2021.05.26 |
| [물질(Matter)이란] 원소, 혼합물, 화합물, 용액의 차이 (0) | 2021.03.03 |



