
산-염기는 크게 세가지의 정의로 나눈다.
아레니우스, 브뢴스테드 로우리, 루이스 산 염기
오늘은 그중에서 브뢴스테드 로우리의 산 염기 정의에 대해서 집중적으로 알아보겠다.
산과 염기의 Arrhenius 정의
산은 물에서 H+을 생성한다.
염기는 물에서 OH-를 생성한다.
중화 반응은 산의 H+ 와 염기의 OH- 가 결합하여 물이 생성된다.
산과 염기의 Brønsted-Lowry 정의
Brønsted-Lowry 모형은 Arrhenius 모형에서처럼
산과 염기의 독립적인 성질보다는 산과 염기 간에 일어나는 반응에 중점을 두고 있다.
산은 H+(양성자) 주개이다.
염기는 H+(양성자) 받개이다.
H+이온은 Brønsted-Lowry반응에서 교환의 매개체이다.
H+ 는 양성자라고 불린다
산-염기반응에서 양성자 교환이 일어난다
산에서 양성자가 제거되어 생긴 화학종을 그 산의 짝염기라 한다.
산이 HB이면 그 짝염기는 B-이다.
짝산과 짝염기의 차이는 양성자의 위치이다.
양성자를 받거나 줄 수 있는 물질을 양쪽성 양자성이라 한다.
물을 생각해 보자:
OH- <- H2O -> H3O+
H+ 제거 H+ 첨가
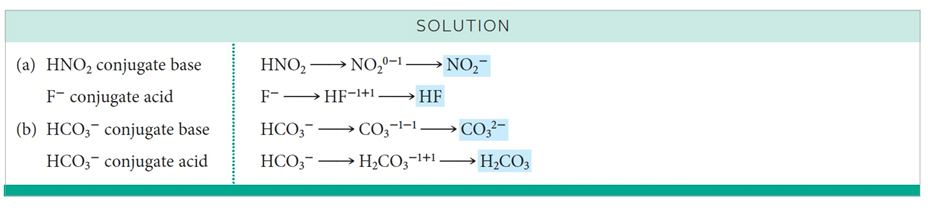
짝산-짝염기의 예

예시문제

물의 이온곱
물은 스스로 반응하여 자체 이온화 반응을 한다.
물은 산-염기 반응으로 자체 반응이 일어난다:
H2O + H2O ⇌ H3O+ (aq) + OH- (aq)
자체 이온화 반응을 나타내는 또 다른 방법은 다음과 같다:
H2O ⇌ H+ (aq) + OH- (aq)
H2O ⇌ H+ (aq) + OH- (aq)
평형 상수는 농도로 표시할 수 있음을 상기하라
이 반응의 평형상수 K는 [H+][OH-]이다
이 반응의 K를 물의 이온곱 상수, Kw 라고 한다
Kw = [H+][OH-]
25 ºC에서 Kw = 1.0 X 10^-14
물에서, [H+][OH-] = 1.0 X 10-14
순수한 물에서, 두 농도는 같다:
[H+] = 1.0 X 10-7 M
[OH-] = 1.0 X 10-7 M
한 농도가 증가하면 다른 농도는 감소한다.
[H+] > 1.0 X 10-7 M 이면, [OH-] < 1.0 x 10-7 M 이고, 산성이다.
[OH-] > 1.0 X 10-7 M 이면, [H+] < 1.0 x 10-7 M 이고 염기성이다.

POH
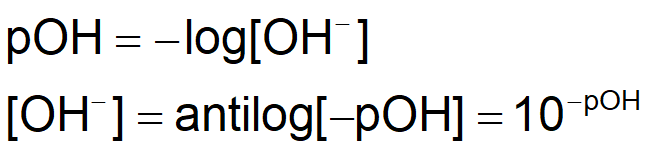
pOH가 높으면 약 염기이다.
pOH가 낮으면 강 염기이다.
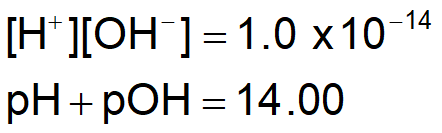
예시문제



'과학 > 화학' 카테고리의 다른 글
| [산과 염기] 루이스(Lewis) 모형 (0) | 2021.05.31 |
|---|---|
| [산과 염기] 약염기, 약염기의 평형상수, Ka와 Kb의 관계 (0) | 2021.05.31 |
| [산과 염기] 약산, 약산의 평형상수, 이온화 백분율, 다양성자 약산 (0) | 2021.05.31 |
| [산화-환원 반응] 산화수 규칙, 산화-환원반응 균형 맞추기 (0) | 2021.05.26 |
| [물질(Matter)이란] 원소, 혼합물, 화합물, 용액의 차이 (0) | 2021.03.03 |



